阿尔茨海默病(Alzheimer's disease [AD],俗称老年痴呆症)是发生在老年前期与老年期的一种神经退行性疾病,主要表现为记忆丧失与认知障碍。AD发病率随着年龄增长而显著增加,同时受遗传、环境和生活方式等影响。关于AD发病机理,存在若干假说,但具体的发病机理目前还不是完全清楚。
目前国际上已经开展了大规模的AD遗传研究,主要包括基于常见变异的全基因组关联分析(Genome-wide association study [GWAS])和基于稀有变异的全基因组/外显子组测序分析(Whole genome sequencing [WGS] / whole exome sequencing [WES])。通过全基因组关联分析研究,人们已在欧洲人群中发现了20余个主要的AD易感基因/易感变异位点。这其中,免疫基因占据了很大比例。通过全基因组/外显子组测序集中分析基因中的稀有变异,目前已发现了两个最重要的AD易感基因 - TREM2和PLD3。在我国,针对AD人群的大规模遗传分析目前尚处于起步阶段。中国科学院昆明动物研究所姚永刚课题组前期研究显示,欧洲人群中识别的主要AD易感基因中,只有PICALM和BIN1基因在亚洲人群中与AD发病风险显著相关(Mol Neurobiol 2014)。我国AD人群的遗传易感是否与免疫基因变异相关,是一个值得深入研究的问题。
近期,中科院昆明动物所姚永刚课题组与中科院自动化研究所蒋田仔课题组合作,在我国两个地区的AD病例对照以及长寿人群中,针对AD相关免疫基因的常见变异进行了较为系统的分析。结果显示,欧洲人群中报道的重要免疫易感基因对我国人群AD遗传易感贡献不大。有趣的是,他们发现前人报道的与老年黄斑变性遗传易感极其相关的一个重要免疫基因,即补体因子H(complement factor H [CFH]),与我国AD人群的易感风险显著相关。该结果在他们研究的两个独立样本中得到验证,同时在世界范围大样本的荟萃分析中也得到证实。进一步针对我国年轻大学生志愿者的遗传影像分析发现,CFH基因的AD风险等位基因携带者与内嗅皮层厚度相关,在年轻时具有较厚的内嗅皮层。基于ADNI(Alzheimer's Disease Neuroimaging Initiative)数据挖掘分析显示,在衰老进程以及AD发病过程中,风险等位基因携带者相比于对照人群,脑萎缩率显著增加,脑脊液中淀粉样蛋白(beta amyloid [Aβ])表达水平显著升高,认知水平显著降低。细胞实验中,过表达Aβ前体基因APP或者PSEN1突变体会导致CFH表达增高,细胞直接用Aβ处理也观察到同样的现象。针对CFH基因及其基因组临近区域的分子进化分析提示,该AD风险等位基因可能由于增加机体抗感染的能力,在人群中受到了正选择,进而在人群中得到保留。这种权衡效应(trade-off effect)使得人类在获得增加的抗感染能力的同时,付出易感阿尔兹海默病和老年黄斑变性等老年疾病的代价。
该研究提供了从进化医学角度解析人类复杂疾病的一个例证,阐明了为什么易感疾病的遗传基础。该研究成果发表在神经精神疾病期刊Neuropsychopharmacology。该研究在研究员姚永刚和蒋田仔指导下完成,论文第一作者是昆明动物所博士研究生张登峰,得到上海精神卫生中心方贻儒团队、四川大学华西医院李涛团队、昆明动物所孔庆鹏课题组大力支持。
在另一项博士研究生张登峰为论文第一作者的研究中,姚永刚团队成员针对近期全基因组测序分析发现的AD风险基因PLD3,进行了稀有功能变异的结构模拟、多群体的荟萃分析,以及该基因所属其他基因家族成员如PLD1和PLD2的表达谱、遗传关联等多层面综合分析,结果显示,PLD3基因的稀有变异p.V232M为功能性变异,能够影响PLD3蛋白的结构与活性,导致AD发病风险,其风险稍高于全基因组关联分析发现的常见变异的效应。并且,其另一家族成员PLD2基因变异和表达水平与AD风险相关。但针对我国18个家族性AD家系的先证者进行的PLD1、PLD2和PLD3全基因外显子测序,没有在这些基因中发现稀有功能变异,显示其影响AD风险可能具有人群特异性。我国人群中与AD相关的稀有功能变异还有待更多的研究。这一研究工作近期发表在Molecular Neurobiology上。
上述研究得到中国科学院脑功能联结图谱先导专项的资助。
文章链接:1 2
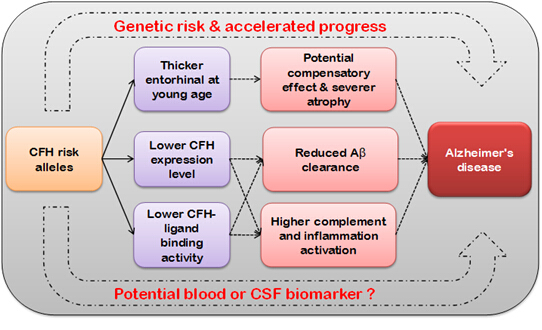
图1. CFH 基因变异影响脑结构与AD发病风险
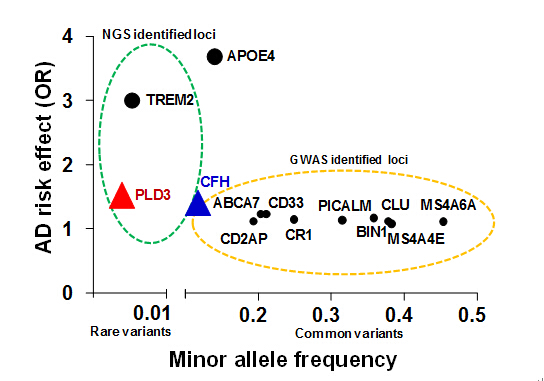
图2. AD主要易感基因与风险效应