昆明动物所在阿尔茨海默病研究中取得进展
阿尔茨海默病(Alzheimer's disease, AD),俗称老年痴呆,是发生在老年期的一种最常见的神经退行性疾病,主要的临床表现为认知和记忆功能逐渐丧失。AD的发病率随着年龄增长而显著增加。随着人口老龄化进程的加剧,全世界AD患者数量目前正在急剧增长。我国是世界上老年人口最多的国家,有着数量最多的AD患者,社会经济负担日趋沉重。探索有效的AD预防、控制和干预方法,直接关系我国人民健康,关系老龄人口生活质量。AD有效干预手段有赖于我们对于其病理生物学机制的认识和理解,并能够寻找到有效的干预靶点。
遗传因素是AD最重要的风险因子之一。流行病学数据显示,AD的遗传力高达79%。前人发现APP、PSEN1和PSEN2是早发家族型AD的致病基因;然而,只有不到5%的患者是由于这些致病基因的突变导致。对绝大部分患者,尤其是晚发性散发病例而言,存在大量的遗传易感基因有待发现。近期的大规模全基因组关联分析在欧洲人群中发现了大量的与晚发性散发型AD遗传风险相关的常见遗传变异位点,对AD遗传机制的解析提供了很多新的思路。然而,领域中有许多问题尚未解决,例如:1)已鉴定的AD遗传风险相关的常见遗传变异位点多位于功能未知的非编码区,从统计学相关到功能基因鉴定、机制解析还有很长的路要走;2)已鉴定的遗传因子主要基于欧洲人群的研究,由于疾病的复杂性与人群遗传背景的异质性,欧洲以外人群的AD遗传因子还没有得到系统深入的研究。目前,针对我国AD群体的系统的遗传分析工作,与我国巨大的AD受累人口极不相称。近期,中国科学院昆明动物研究所研究员姚永刚团队联合多家医院,针对我国AD群体开展了较为系统的遗传分析工作,并取得了系列进展。如发现补体因子C7基因的稀有的错义突变rs3792646能显著提高我国人群AD发病风险(Zhang et al. 2019 National Science Review),线粒体复合物IV相关基因的遗传变异,通过调控相应基因的表达水平而影响AD病理变化(Bi et al. 2018 Neuropsychopharmacology),并基于AD病理组织基因表达数据整合分析,搭建了AD数据库AlzData(www.alzdata.org; Xu et al. 2018 Alzheimer & Dementia)。
在最近的一项工作中,姚永刚团队运用遗传学手段,结合全基因组测序与全外显子组测序,发现乙酰转移酶ACAA1基因的稀有错义突变rs117916664(p.N299S)可显著提高我国汉族人群早发性AD的发病风险。研究人员分别从分子、细胞和小鼠动物模型等多层次,对该突变开展了系统的研究,发现p.N299S突变可降低ACAA1的酶活性。在细胞模型层面,ACAA1 p.N299S突变可使得神经细胞溶酶体功能紊乱,影响突触功能蛋白的表达,并且该效应与细胞中敲除ACAA1基因的效应相一致。在动物模型层面,ACAA1 p.N299S过表达可加速AD小鼠模型的学习记忆功能的衰退,并加速Aβ病理生理学特征以及海马区域神经元的丢失。进一步机制解析发现,ACAA1 p.N299S导致的Aβ的沉积以及神经元功能的紊乱,是由于溶酶体功能缺陷导致的自噬受阻引起。由于ACAA1基因是长链脂肪酸代谢途径的最后一个代谢酶,该发现将AD的发生与脂类代谢紊乱予以关联。该工作不仅发现了我国AD患者的一个新的重要致病突变,还证实了自噬-溶酶体系统清除Aβ,对于维持神经元功能非常重要,这为AD疾病机理的解析提供了基础数据,也为未来的AD药物研发提供了新的干预靶点。
该研究工作近期以A novel missense variant in ACAA1 contributes to early-onset Alzheimer’s disease, impairs lysosomal function, and facilitates amyloid-β pathology and cognitive decline为题,发表在Signal Transduction and Targeted Therapy上。
昆明动物所副研究员罗荣灿、博士范宇为该论文的共同第一作者,姚永刚与罗荣灿为该论文的共同通讯作者。该工作得到了昆明动物所研究员盛能印、中南大学附属湘雅二医院教授谭立文、上海交通大学附属上海精神卫生中心教授张晨以及昆明医科大学第一附属医院副教授姜红燕的大力支持与帮助。该研究得到了国家自然科学基金委和中国科学院的资助。
文章链接:https://doi.org/10.1038/s41392-021-00748-4
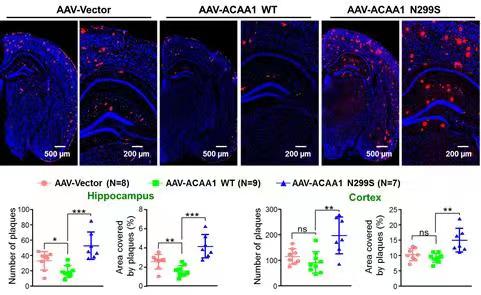
图1.ACAA1基因p.N299S突变可显著促进AD模型小鼠Aβ病理生理学特征的进程
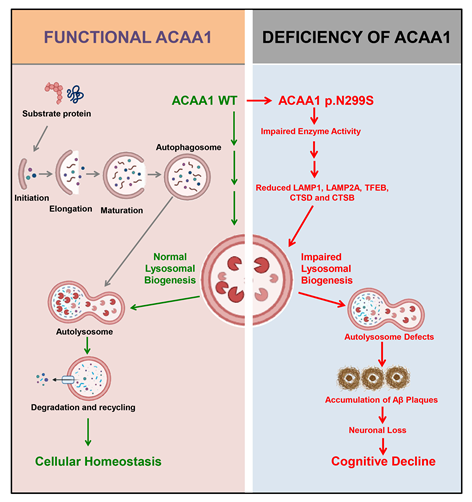
图2. ACAA1基因p.N299S突变通过破坏自噬-溶酶体系统,从而促进AD的进程
