昆明动物所等发现一条新的调控SREBP-SCD和脂代谢的环路
近日,中国科学院昆明动物研究所梁斌实验室与昆明动物所施鹏实验室、广东医科大学开展合作研究,揭示了一条新的调控SREBP-SCD功能和脂代谢的环路。该研究成果发表在国际脂代谢领域知名期刊Journal of Lipid Research上。
脂类,如脂肪酸、甘油三酯、磷脂、胆固醇等,不仅是重要的信号分子和能量储存分子,而且也是组成生物膜的主要成分。脂类与生物体的生长、发育、抗逆境等各种生命活动息息相关!脂类代谢紊乱与肥胖、糖尿病、动脉粥样硬化、脂肪肝、肿瘤等人类重大疾病密切相关。
固醇调节元件结合蛋白(Sterol regulatory element binding proteins,SREBPs)是调控脂肪酸合成、胆固醇合成的重要转录因子。在哺乳动物中,SREBPs进化为两个基因,SREBF-1和SREBF-2。SREBF-1转录为SREBP-1a和SREBP-1c,SREBP-1c主要调控脂肪酸合成,最近的研究表明SREBP-1c响应胞内磷脂酰胆碱水平(phosphatidylcholine,PC)调控PC的合成(Walker et, Cell 2011);而SREBP-2响应胞内胆固醇含量负向调控胆固醇合成(Brown and Goldstein, Cell 1997)。SREBP-2的靶基因HMGCR(HMG-CoA reductase)是目前市场上他汀类药物的靶点。
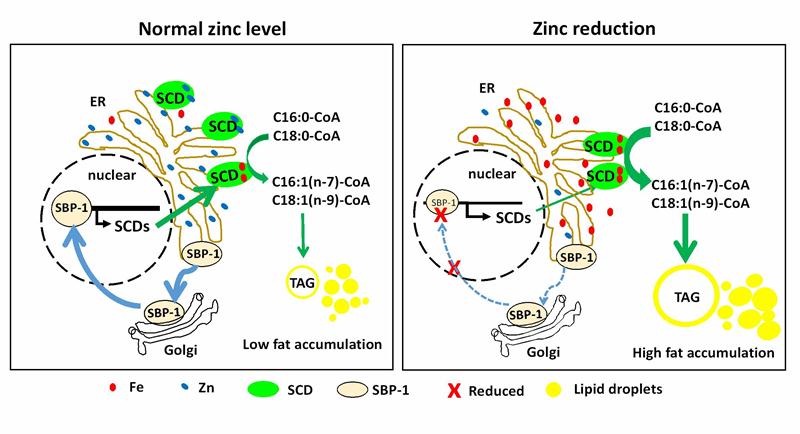
除了PC和胆固醇外,SREBP是否也受其它因子调控呢?为了解答这个问题,昆明动物所梁斌实验室联合施鹏实验室(博士郝军军),以及广东医科大学教授李明意和廖辉来,利用模式生物秀丽线虫,全基因组筛选寻找调控srebp(sbp-1)突变体的的抑制子(Suppressors)。研究人员惊奇的发现,秀丽线虫SREBP同源蛋白SBP-1负调控锌的水平,同时也受锌调控。在正常情况下,锌促进SBP-1从胞质转入细胞核,转录激活其下游靶基因——硬脂酰辅酶A去饱和酶(Stearoyl-CoA Desaturase, SCD)的表达;同时,SREBP负调控胞内锌的水平,防止过高的锌会替代SCD的活性离子铁,抑制SCD活性。当胞内锌水平下降时,SREBP从胞质转移到细胞核内受阻,SCD的转录水平下降;然而,低锌水平反过来会提高胞内铁水平,过多的铁离子进入SCD,进而激活SCD活性,上调脂肪的合成和积累。
该研究揭示了一条新的调控SREBP-SCD功能和脂代谢的环路,即SREBP响应胞内锌水平,并负调控锌代谢;锌和铁互相拮抗,调控SREBP靶基因SCD的功能和脂肪合成。该项目研究对我们了解脂代谢、锌和铁代谢相关疾病的发病机理和治疗提供了全新的视野。
梁斌实验室的博士张静静是论文的第一作者。该项研究工作得到了中国科学院先导B类、国家自然科学基金、中国博士后基金、云南省高端人才等项目资助。
文章链接:http://www.jlr.org/content/early/2017/07/14/jlr.M077198.long
昆明动物所等发现一条新的调控SREBP-SCD和脂代谢的环路