昆明动物所在miRNA调控乳腺癌血管新生的研究中取得进展
1月25日,Oncogene期刊以Hypoxia induces miR-153 through the IRE1α-XBP1 pathway to fine tune the HIF1α/VEGFA axis in breast cancer angiogenesis为题,在线发表了中国科学院昆明动物研究所陈策实课题组在miRNA调控乳腺癌血管新生功能与机制研究中的进展。该研究揭示了受缺氧应激诱导的miR-153通过下调HIF1α/VEGFA信号通路而抑制乳腺癌的血管新生。
实体瘤的生长依赖于血液为其提供充足的营养和氧气。因肿瘤细胞具有增殖快速且不受调控的特点,在实体瘤内部极易出现缺氧微环境。为应对缺氧压力,肿瘤细胞通过激活HIF1α/VEGFA信号通路而促进肿瘤内血管新生,因此通过靶向该信号通路而将肿瘤的发展阻断在血管新生的早期,则能有效抑制实体瘤的生长、侵袭、以及转移。MiR-153是一个古老且进化保守的miRNA分子,在多种类型的肿瘤中扮演着肿瘤抑制因子的角色。研究人员前期研究发现米非司酮可以诱导miR-153,从而抑制KLF5转录因子表达来抑制乳腺癌干细胞(Liu, R. et al., Theranostics, 2016)。但对于miR-153在肿瘤中表达调控机制,以及该miRNA分子在调控肿瘤细胞活性中的功能和机制尚未完全清楚。
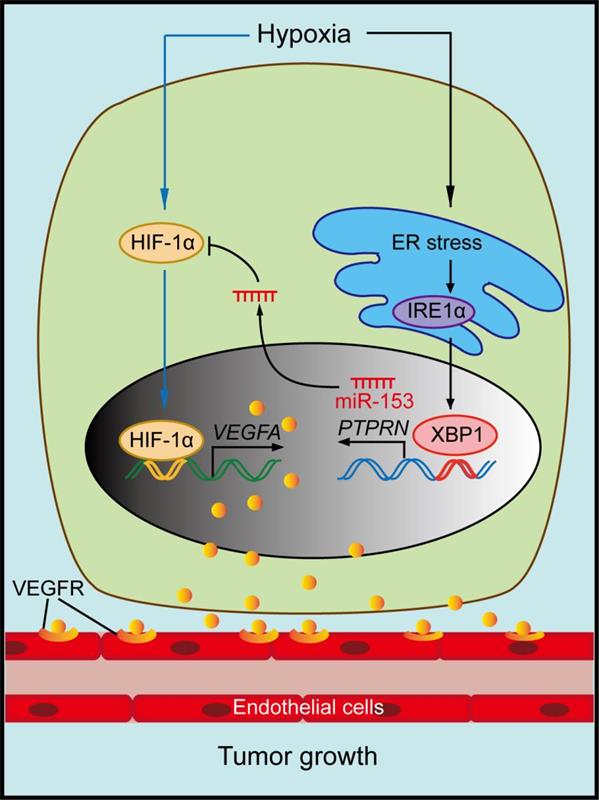
该研究发现miR-153通过靶向作用于HIF1A癌基因mRNA的3’UTR而抑制缺氧对乳腺癌细胞中HIF1α/VEGFA信号通路的激活,从而阻断肿瘤的血管新生,抑制裸鼠移植瘤的生长。该工作还进一步探讨了miR-153的表达调控机制,并发现缺氧可通过触发细胞内的内质网应激(ER stress)反应而激活IRE1α/XBP1信号通路,被激活的转录因子XBP1通过作用于miR-153宿主基因PTPRN的启动子区域而诱导PTPRN和miR-153的共同表达。因此,在缺氧的病理生理条件下,肿瘤细胞一方面快速激活HIF1α/VEGFA通路而促进肿瘤的血管新生,同时也可通过激活内质网应激上调miR-153,从而实现对HIF1α/VEGFA信号通路的负性微调,与其他负性调控因子一起以类似“刹车机制”避免肿瘤细胞内该信号通路的过度激活,维持正常和肿瘤组织的稳态(如图)。在证明了miR-153抑制乳腺癌干细胞的前期基础上,该工作清楚表明miR-153的确是一个强的抑癌基因,可以通过抑制血管新生抑制乳腺癌,miR-153也许将来可以用于乳腺癌的基因治疗。
陈策实课题组博士梁慧春为文章的第一作者,研究员陈策实和刘蓉为文章共同通讯作者。该工作得到了中国科学院战略先导专项、国家自然科学基金以及云南省应用基础研究重点项目的资助。
文章链接:https://www.nature.com/articles/s41388-017-0089-8
缺氧条件下miR-153表达调控及其靶向HIF1α/VEGFA通路模式图