昆明动物研究所发表系列研究成果阐明多能干细胞基因组稳态维持新机理
多能干细胞(Pluripotent stem cells, PSCs)因其在体外具有无限增殖和分化为不同类型细胞的潜能,在再生医学领域中具有广泛应用前景,也成为目前临床上最具潜能的成药细胞。PSCs制备过程中的标准化、规模化及细胞质量稳定性是其走向临床应用的先决条件.但人PSCs在体外扩增培养过程中,易出现遗传和表观遗传的变异,严重阻碍了PSCs的临床应用。因此,研究PSCs遗传物质稳定性维持机理,是寻找改善策略、突破应用瓶颈的关键。
PSCs基因组的突变率远低于分化细胞。中国科学院昆明动物研究所研究员郑萍团队和其他团队的前期研究表明,PSCs利用不同于体细胞的特殊机制,有效调控基因组稳定。郑萍团队前期已鉴定了PSCs在DNA复制、DNA损伤修复中的一些特殊分子及作用机制。近期研究团队鉴定了一个在小鼠胚胎干细胞(mouse Embryonic Stem cells, mESCs)中特异表达的全新长链非编码RNA-LncRNA NONMMUT028956 (简写为Lnc956)。对该LncRNA的系统研究发现它不仅参与复制压力下mESCs复制小体稳定的维持,而且还监控mESCs基因组的质量,从而确保mESCs基因组稳态。
长非编码RNA在多种生物学功能中起重要作用。由于技术手段的限制,目前还没有发现复制叉上具有功能性长非编码RNA的报道。研究团队利用前期研发的一个新技术-分离新生DNA链上(即复制叉)RNA技术(isolate RNAs on nascent DNA ,iROND)首次鉴定了ESCs复制叉上特异的新的功能性LncRNA-Lnc956。对该LncRNA的研究发现,当复制压力发生时,Lnc956能有效聚集到复制叉上,并大量招募Trim28和Hsp90b1聚集于复制叉形成复合体。Trim28能直接与DNA复制解旋酶复合体MCM2-7相互作用,直接拉近了Lnc956-Trim28-Hsp90b1复合体与MCM2-7复合体之间的物理距离,使得分子伴侣Hsp90b1通过其GTP水解活性作用于MCM7,阻碍MCM7进行K48和K63泛素化(MCM7泛素化会导致复制小体解离),从而使得复制小体能在一定程度复制压力情况下得以稳定,保持了基因组的完整性。研究团队也发现Lnc956缺失会导致小鼠胚胎部分致死,致死原因主要是胚胎细胞大量扩增过程中,细胞出现明显基因组不稳定现象,并导致胞质DNA水平显著增加,引起较严重的炎症反应。总之,该研究结果首次发现了小鼠多能干细胞复制叉上特异性功能性长非编码RNA-Lnc956,并揭示了Lnc956维持多能干细胞基因组稳定和促进胚胎发育的分子机制。
有效清除基因组损伤的细胞个体,是干细胞维持群体基因组稳定的重要方式。p53是目前已知唯一的干细胞基因组质量监控分子。p53通过在转录水平上抑制多能性调控网络关键基因的表达,激活分化调控网络基因的转录,使PSCs快速启动分化和凋亡,确保PSCs的基因组质量。除了p53通路,是否还存在其他独立的机制调控损伤干细胞的清除,值得进一步研究。
研究团队针对新鉴定的LncRNA-Lnc956在干细胞质量控制中发挥的作用做了深入探索。利用多种DNA损伤药物处理、分化、凋亡、单克隆形成、克隆竞争性和转录组学等方法对该LncRNA功能研究后发现,缺失Lnc956的ESCs在受到DNA损伤后不易启动分化和凋亡,提示Lnc956参与DNA损伤后ESCs的分化和凋亡。但是,Lnc956缺失的ESC中,p53通路的激活和功能未受影响,提示p53没有介导Lnc956的调控作用。为探究Lnc956分子水平上具体作用机理,研究人员利用In vitro/in vivo RNA pull down、蛋白质质谱及RNA免疫共沉淀等技术鉴定出与Lnc956相互作用的靶蛋白-KLF4。机制分析发现,在未受DNA损伤时,Lnc956与KLF4无相互作用。而在基因组受损后,DNA损伤反应通路的核心激酶 ATM 激活,ATM活化 Mettl3 (调控RNA m6A修饰),使 Lnc956 发生m6A修饰。发生 m6A修饰的Lnc956大量结合干性维持关键蛋白 KLF4。Lnc956-KLF4结合体滞留KLF4蛋白,阻止KLF4蛋白对ESCs多能性的调控,阻止其结合到DNA上行使干性调控功能,使基因组损伤的干细胞快速发生分化,得以清除。Lnc956-KLF4通路不依赖p53,和p53通路平行,共同对干细胞基因组质量进行监控。因此,当ESCs受到DNA损伤应激时,磷酸化的ATM信号通路可分别激活p53和Lnc956-KLF4两条通路,使未受DNA损伤修复的ESCs快速发生分化和凋亡,高效清除受损ESCs,防止其传递到子代,确保了ESCs遗传物质的稳定性和安全性。
以上研究分别以Lnc956-TRIM28-HSP90B1 complex on replication forks promotes CMG helicase retention to ensure stem cell genomic stability and embryogenesis和Lnc956 regulates mouse embryonic stem cell differentiation in response to DNA damage in a p53-independent pathway为题刊发于Science Advances杂志。昆明动物所博士张伟道及博士研究生唐敏为第一篇文章的共同第一作者,郑萍和昆明动物所研究员赵博为该文的共同通讯作者。昆明动物所副研究员马怀孝、博士研究生宁雨琪和副研究员王林为第二篇文章的共同第一作者,郑萍和马怀孝为该论文共同通讯作者,上述两个工作得到基金委自然科学基金(31930027)等的资助。
文章链接1:https://www.science.org/doi/10.1126/sciadv.adf6277
文章链接2:https://www.science.org/doi/10.1126/sciadv.ade9742
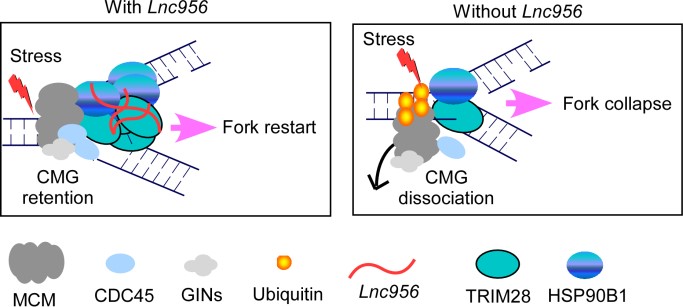
图 1. Lnc956维持复制叉稳定促进多能干细胞基因组稳定的分子机制
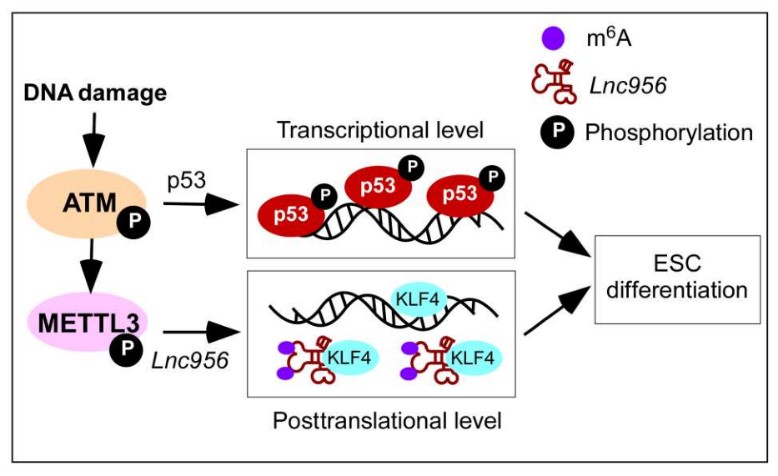
图2. p53和Lnc956协调调控ESCs质量控制的工作模型
