韧革菌素生物合成研究揭示oxepinone形成酶
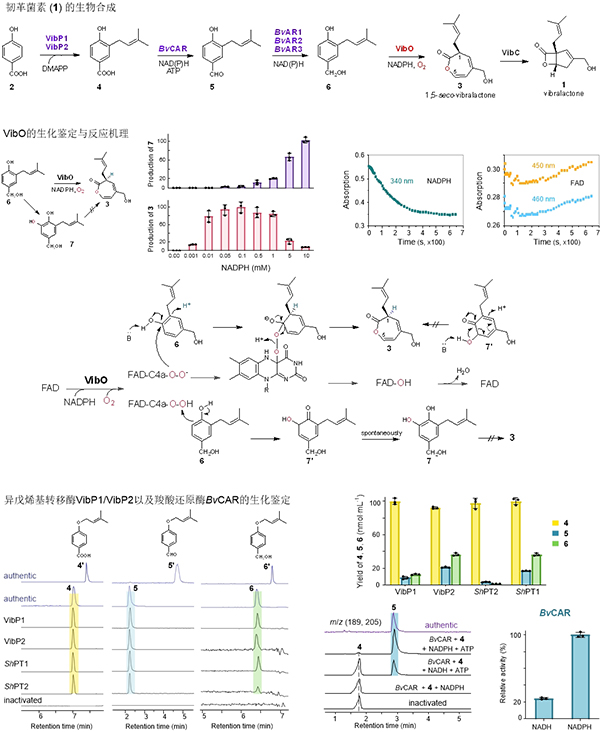
Oxepinone环在天然产物的骨架结构中颇为独特。尽管已有研究表明GilOII加氧酶能够产生含oxepinone的中间体,但随即发生中间体开环脱羧的连续催化导致酶产物并不具有oxepinone骨架。因此,特异形成oxepinone产物的酶尚待发掘。高等真菌褐盖韧革菌 (Boreostereum vibrans) 发酵液不仅富含混源萜类次生代谢产物韧革菌素 (vibralactone,1),还能够显著积累含oxepinone骨架结构的产物1,5-seco-vibralactone (3)。中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室曾英专题组,围绕韧革菌素的生物合成开展研究工作,2013年以来相继揭示了韧革菌素的融合双环内酯骨架来源于对羟基苯甲酸 (Angew. Chem. Int. Ed. 2013, 52, 2298-2302; DOI: 10.1002/anie.201208182),经由中间体6发生芳环加氧扩环反应形成产物3的oxepinone骨架 (Angew. Chem. Int. Ed. 2016, 55, 5463-5466; DOI: 10.1002 /anie.201510928),后续由环合酶VibC催化oxepinone单元发生分子内环合反应生成韧革菌素 (Angew. Chem. Int. Ed. 2020, 59, 7209-7213; DOI: 10.1002/anie.202000710)。然而,对羟基苯甲酸 (2) 如何转化为含oxepinone的产物3,包括相应的催化酶及反应中间体仍属未知。
在此次研究中,曾英专题组研究人员首先采用酶活性导向分离和蛋白质组分析技术手段,从褐盖韧革菌菌丝总蛋白提取物中分离鉴定了催化6加氧扩环形成oxepinone产物3的黄素单加氧酶VibO,证明其黄素辅因子为FAD,且严格依赖NADPH;确定了VibO酶反应副产物7的化学结构,很显然7来自6的邻位羟化,但褐盖韧革菌发酵液中并未检测到7的存在。研究发现,随着NADPH浓度增加,3的产量达到高点后迅速下降,而羟化产物7的积累则持续攀升;VibO不能将7转化为3,更不能促使3变成7。由此可见,氧化6生成3和7的路径不同,VibO不可能采取羟化路径形成产物3的oxepinone环。通过同位素标记和NMR分析酶产物,研究人员进一步确定了加入分子氧及交换氢的位置。
随后,曾英专题组与上海有机化学研究所潘李锋课题组开展合作,解析了VibO的晶体结构、活性部位、以及催化机理。尽管VibO在结构上与催化苯酚发生邻位羟化反应生成儿茶酚的羟化酶相近,但结构分析及生化研究结果支持VibO采取Baeyer-Villiger氧化形成oxepinone环。光谱分析发现,VibO在不添加底物6时仍然消耗NADPH,反应速度及消耗量几乎等同于存在6的酶反应;静态及动态光谱特征表明黄素中间体为FAD-C4a-OO(H)。此外,研究人员还鉴定了催化对羟基苯甲酸 (2) 生成4的膜结合型异戊烯基转移酶VibP1/VibP2,以及将中间体4分步还原为6的羧酸还原酶BvCAR和醛还原酶BvAR1/BvAR2/BvAR3。至此,研究人员彻底阐明了韧革菌素生物合成的酶分子机制,并采用一锅法从对羟基苯甲酸成功合成3和1,同时还利用大肠杆菌实现了韧革菌素的异源合成。
该研究成果以A flavin-monooxygenase catalyzing oxepinone formation and the complete biosynthesis of vibralactone为题,在线发表于Nature Communications。曾英专题组的博士后冯克娜和博士研究生张悦,以及上海有机化学研究所博士研究生张明芳为本文共同第一作者,曾英研究员和上海有机化学研究所潘李锋研究员为本文的共同通讯作者。这项工作得到国家合成生物学重点研发计划、国家自然科学基金等项目资助。