昆明动物所揭示阿尔茨海默病遗传风险基因座内多变异-多基因作用机制
阿尔茨海默病(AD)是最常见的老年神经退行性疾病,社会负担沉重,其发生发展受多种遗传因素的影响。目前,基于大规模病人-对照人群的遗传学研究,特别是全基因组关联分析(GWAS),已鉴定到了近百个可靠的AD遗传风险相关基因座(loci),为AD发病机制研究和药物靶点发掘提供了良好契机。然而,大部分基因座包括几十到上百个紧密连锁的、统计学相关的非编码区变异和多个表达高度相关的基因,从中识别真正具有生物学效应、且与疾病发病相关的变异(功能变异,causal variant)和基因(致病基因,causal gene)是AD遗传学研究的热点和难点。
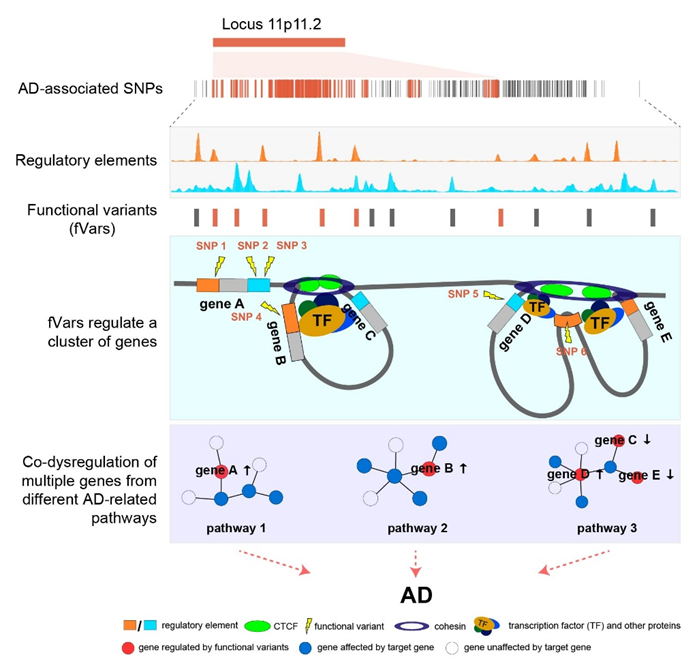
11p11.2基因座位于11号染色体短臂,长度约为1.5 Mb,覆盖400多个AD相关变异和约50个基因,是最为复杂的AD风险相关基因座之一。按照传统观点,一个疾病风险相关信号的基因座可能提示一个致病基因;然而,前人针对11p11.2基因座的致病基因鉴定始终难以得到一致的结论。事实上,疾病风险基因座的致病基因定位研究,还缺乏系统的、理论性的研究范式。中国科学院昆明动物研究所研究员姚永刚及张登峰团队长期从事AD的遗传机制研究。在研究团队的前期分析中发现,虽然11p11.2在GWAS中属于同一个统计关联信号,但是该基因座内的AD相关变异位于多个彼此独立且效应方向不同的遗传连锁群,并与多个基因表达相关,因而推测一个风险基因座可能指向多个独立的致病信号。为了验证这一猜想,研究团队开展了系统的功能基因组学筛选和功能实验研究。
通过整合AD相关大规模GWASs、脑组织和神经细胞的组蛋白修饰、染色质开放状态、转录因子结合等多个层面的组学数据,研究团队从11p11.2基因座数百个变异位点中鉴定到了24个,而非1个,潜在的功能变异。这些变异可能通过影响其所在调控元件与转录因子的结合,进而调控靶基因的表达;使用独立的整合算法也表明该风险基因座中存在多个功能变异和效应基因。等位基因特异性表达分析和双荧光报告实验进一步证明上述变异确实是功能变异。随后,结合基因表达调控、三维染色质互作、单碱基编辑和染色质可及性测序,团队发现这些功能变异能够通过长距离染色质作用,同时调控多个靶基因的表达。为确认这些靶基因的表达改变确实参与AD发生,而不是由于基因表达调控多效性导致,研究团队开展了进一步分析和实验。研究发现,与统计分析和表达调控结果一致,受这些功能变异调控的6个潜在致病基因(MTCH2、ACP2、NDUFS3、PSMC3、C1QTNF4和MADD)的组蛋白修饰、mRNA和蛋白水平在AD患者脑组织也存在表达改变;在胶质细胞系中敲降或过表达这些潜在致病基因则发现,这些基因的表达改变均能够影响AD核心病理分子淀粉样蛋白Aβ和磷酸化Tau蛋白水平,提示这些潜在致病基因确实可能参与AD的发病进程。
据此,研究团队提出了11p11.2基因座“多变异-多基因协同贡献AD遗传易感风险”的假说,即一个统计信号提示的风险基因座内有多个功能变异,调控了该基因座内多个基因的表达改变,进而协同贡献于AD的发病风险。这一假说不仅适用于11p11.2,可能同样适用于其他具有复杂连锁和表达调控模式的疾病风险基因座。该研究有望为AD诊治提供新的思路和靶标,同时也为遗传变异贡献于复杂性状的机制研究,尤其是统计模型的开发,提供概念和范式上的创新。
近日,以上研究以Coexistence of multiple functional variants and genes underlies genetic risk locus 11p11.2 of Alzheimer’s disease为题发表于Biological Psychiatry ,昆明动物所副研究员徐敏、刘前进及毕蕊为文章的共同第一作者,姚永刚和张登峰为共同通讯作者,研究员李明及罗雄剑对该研究工作给予了大量帮助和支持。
以上研究工作得到国家自然科学基金委、科技部、中国科学院和云南省的资助。
文章链接:https://www.biologicalpsychiatryjournal.com/article/S0006-3223(23)01330-6/fulltext
图1. 风险基因座内多变异-多基因协同贡献AD遗传易感风险