昆明动物所发现多能干细胞保持高保真DNA复制和修复的新机制
多能干细胞具有发育的全能性,可在体外分化为各类组织、细胞,具有广阔的应用前景: 可以作为再生医学中的重要种子细胞,也可以在药物研究中筛选临床治疗药物,还可以在体外模拟发育的过程。由于发育地位特殊,多能干细胞基因组具高度稳态(如小鼠胚胎干细胞的基因组变异率仅为胚胎成纤维细胞的1/100)。然而,多能干细胞在体外长期大量扩增培养、持续的DNA复制及特殊的细胞周期往往导致基因组变异,破坏其分化潜能,并产生致瘤风险,成为多能干细胞广泛应用特别是走向临床应用的瓶颈难题。研究多能干细胞维持基因组稳态的特殊机制,有助于解决长期大量扩增培养产生的基因组变异难题。
DNA复制是细胞基因组不稳定的最主要的原因。在遭遇DNA复制障碍时,停顿的DNA复制叉不稳定,易发生坍塌,形成DNA双链断裂。DNA双链断裂(DSB)是一种极为严重的DNA损伤形式, 错误的DSB的修复,将导致细胞死亡或癌变。为避免复制叉坍塌,细胞可利用低保真的DNA聚合酶REV1直接进行跨损伤DNA合成(Translesion DNA synthesis, TLS)。若细胞遭遇DSB,细胞主要通过以下三种方式修复DNA:非同源末端连接(nonhomologous end joining, NHEJ),同源重组修复(homologous recombination, HR),和微同源末端连接修复(microhomology-mediated end-joining, MMEJ)。其中MMEJ修复途径保真度最差,突变率最高,由Polq基因编码的Polθ介导。面临巨大复制压力的胚胎干细胞如何避免低保真的DNA复制和修复方式,维持极高的基因组稳态,其中机制并不清楚。
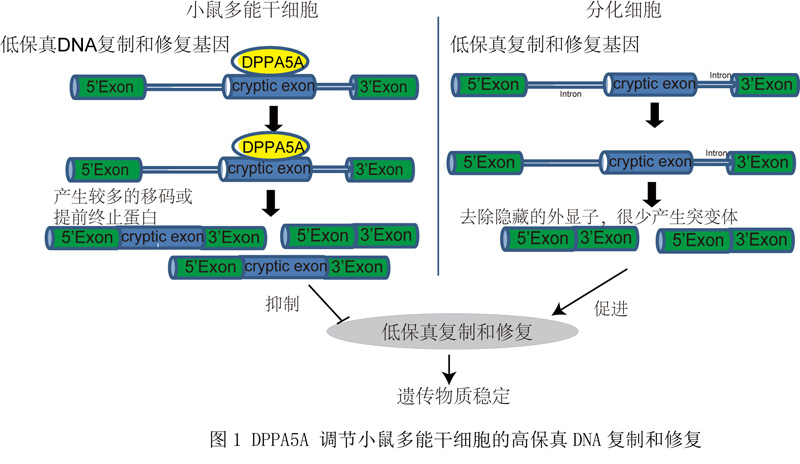
近期,中国科学院昆明动物研究所研究员郑萍团队发现,在小鼠胚胎干细胞中,许多经典的DNA损伤反应基因具有 “隐藏外显子”(cryptic exon)插入事件。“隐藏外显子”的插入导致mRNA翻译提前终止,破坏蛋白翻译和功能。研究聚焦于参与TLS途径的Rev1基因和参与MMEJ途径的Polq基因。二者在小鼠胚胎干细胞中存在高比例的“隐藏外显子”插入,使得小鼠胚胎干细胞中正常的REV1和POLθ蛋白表达显著降低,从而抑制TLS和MMEJ途径。为找到调节二者的剪接因子,研究团队体外合成了Rev1的“隐藏外显子”,利用体外RNA-pulldown鉴定了Rev1“隐藏外显子”的结合蛋白DPPA5A(小鼠胚胎干细胞特异表达蛋白)。在小鼠胚胎干细胞中,敲低Dppa5a可减弱Rev1和Polq的“隐藏外显子”插入频率,增强TLS和MMEJ途径的活性,抑制同源重组修复。Dppa5a敲低细胞表现出基因组不稳定的表型,包括非整倍体的细胞增加,染色体发生黏连,易于在体内形成畸胎瘤等。与之相反,在体细胞中过表达Dppa5a表现出相反的表型。机制研究表明,DPPA5A直接结合到Rev1“隐藏外显子”的GA富集区,与剪接复合体中的U2相互作用,促进Rev1的“隐藏外显子”插入。以上研究揭示了多能干细胞保持高保真DNA复制和修复的新机制。
7月17日,相关研究结果以DPPA5A suppresses the mutagenic TLS and MMEJ pathways by modulating the cryptic splicing of Rev1 and Polq in mouse embryonic stem cells为题发表于PNAS。昆明动物所博士研究生姜方洁与副研究员王林为文章的共同第一作者,郑萍为文章的通讯作者。
该研究由国家重点研发计划、国家自然科学基金和云南省基础研究计划资助完成。
文章链接: https://www.pnas.org/doi/10.1073/pnas.2305187120