昆明植物所在真菌烯化吲哚生物碱的代谢耦合串联机制解析中取得进展
Metabolon是代谢途径中酶与酶形成的临时的结构-功能复合体,可增加代谢流,并“一体化压铸”目标产物。真菌烯化吲哚生物碱结构复杂多样,展现出多种显著的生物活性,是天然产物研究的热点。其中,具有细胞毒活性的化合物(+)-notoamide B及其非差向异构体(+)-versicolamide B共存于多种真菌中。虽然,蘋哪醇重排以及Diels–Alder 加成等步骤被认为包含在其生源合成中,但它们的顺序与机制一直悬而未决。北京大学深圳研究生院吴云东研究员团队以及中国科学院昆明植物研究所植物化学与天然药物重点实验室郝小江研究员团队合作开展天然产物生物合成机制的研究。日前,两个团队合作解析了普遍共存的两种生物碱的生物合成途径,并提出SpeF/SpeG metabolon “一体化压铸”notoamide E, 生成 (+)-notoamide B和 (+)-versicolamide B 的机制。
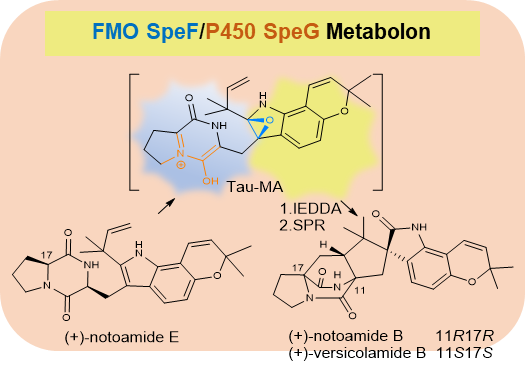
图1 (+)-notoamide B及其非差向异构体(+)-versicolamide B 的生物合成途径
研究团队首先采用antiSMASH工具在赭曲霉基因组中识别出生物合成notoamides的基因簇spe。通过基因敲除、异源重建以及天然产物化学方法,验证了spe基因簇编码的FAD氧化酶SpeF和P450氧化酶SpeG,在(+)-notoamide E向(+)-notoamide B及(+)-versicolamide B转化中依次发挥关键作用(图1)。通过饲喂实验以及结构分析,进一步明确了SpeG 的底物是活性环氧中间体,且其起始氧化位置在C-17位,随后异构化为关键的含环氧的氮杂二烯正离子中间体tau-MA。化学计算和势能面分析揭示了IEDDA(Inverse-Electron-Demand Diels-Alder)是构建这两个化合物二氮辛烷结构单元的主要机制。而随后的环氧开环,C3-O键断裂比C2-O更有利,这也与最终产物结构相吻合。由于这两个过程能垒较低,产量与计算基本一致,研究人员推测这两个过程并不需要酶对底物的专一性识别。随后,研究人员进行了蛋白共定位分析和酵母双杂实验,结果显示,SpeF和SpeG之间可以发生互作,形成稳定的Metabolon,有助于不稳定的环氧中间体在两个蛋白之间传递,验证了生物合成机制的合理性(图2)。这一发现不仅为研究人员深入理解notoamides的生物合成机制提供了新视角,也为未来的合成生物学和代谢工程研究奠定了坚实基础。
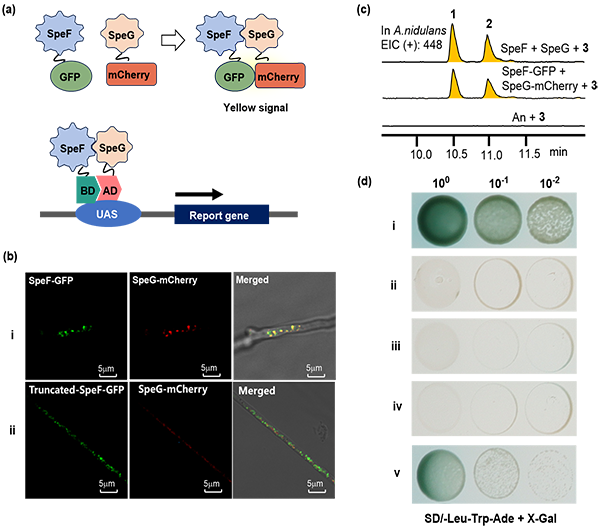
图2 SpeF和SpeG之间的互作研究
近日,这一成果以Deciphering fungal metabolon coupling tandem inverse-electron-demand Diels-Alder reaction and semipinacol rearrangement for the biosynthesis of fused polycyclic alkaloids 为题在线发表在化学国际期刊Science China Chemistry。中国科学院昆明植物研究所刘帅博士,邸迎彤研究员,以及北京大学深圳研究生院续文强博士为论文第一作者,昆明植物研究所植物化学与天然药物重点实验室邸迎彤研究员、郝小江研究员以及北京大学深圳研究生院吴云东研究员为论文通讯作者。此外,上海交通大学的唐满成教授,中国科学院昆明植物研究所的曹明明研究员、杨俊波研究员、郭晗研究员、曾英研究员、徐梓斐副研究员、陈定康、常耀文、汤红玉、贵州医科大学天然产物中心苑春茂研究员参与了部分工作。研究得到了国家自然科学基金(U1812403,2193304,81573323,31770392,22177050)、云南省科技厅项目(202003AD150012,202201AS070040, 202302AA310035)等项目的资助。
