昆明动物所合作发现人类大脑神经前体细胞发育的演化创新机制
人类大脑是人类智力起源和演化的结构基础,在几百万年的演化历程中人类的脑容量显著扩大,这也是人类区别于其他物种的重要特征之一。在演化发育生物学的视角下,物种之间的演化差异在器官发育过程中展现和被选择。因此,人类脑容量的扩增是由于人类演化出了独特的大脑发育模式和细胞类型组成。例如,人类大脑在胚胎期具有更大的神经发生区域OSVZ(outer subventricular zone),其中包含丰富的具有干性的oRG(outer radial glia)细胞,能够分化形成更多的皮层上层神经元。然而,目前对人类神经前体细胞是否演化出独特的细胞类型、分子特征及和分化命运,以及背后的遗传机制的了解相对较少。以往的研究主要通过对人类和黑猩猩类脑器官的跨物种比较揭示人类大脑演化的遗传机制,但现有类器官技术还不能全面模拟脑的发育,导致此类研究具有很大局限性。猕猴与人类具有较近的亲缘关系,在人类大脑的起源、发育机制和脑疾病的研究中,猕猴是更为理想的动物模型。
为了进一步揭示人类大脑在细胞和分子水平的演化创新机制,中国科学院昆明动物研究所研究员宿兵团队与北京大学研究员李程团队合作,对大脑皮层神经发育高峰期的人类、猕猴和小鼠的前额叶皮层进行了单细胞多组学的跨物种整合分析。研究发现,虽然大脑皮层的细胞类型组成在物种间总体上是保守的,但灵长类的胚胎发育中期的OSVZ层具有更丰富的胶质前体细胞(gIP),能够分化形成少突胶质细胞和星形胶质细胞。而在小鼠中,这些细胞类型在接近出生时(E18时期)才会出现,说明灵长类的胶质细胞发生比啮齿类物种更早。这种演化现象背后究竟有怎样的生物学功能,需要后续更多的研究来挖掘。
进一步,研究团队对神经前体细胞(radial glia)的转录组特征进行了跨物种比较分析,发现人类神经前体细胞在生长因子和细胞外基质(ECM)相关通路中表现出广泛的转录组重构。例如,人类神经前体细胞中特异高表达ITGA2基因,该基因所编码的蛋白是介导细胞和ECM之间连接的跨膜蛋白,并向细胞内传导ECM的化学成分和机械应力信号。为了验证这些发现,研究团队将人类ITGA2基因在小鼠胎脑中过表达,发现能够增加小鼠神经前体细胞的增殖和皮层上层神经元的比例。这些结果说明,人类大脑特异的ECM相关基因转录调控对神经前体细胞的增殖具有重要作用。
此外,研究团队还利用单细胞染色质开放性数据和跨物种基因组序列比较数据,进一步揭示了人类神经前体细胞特异的转录调控遗传基础和疾病关联。研究团队将人类精神疾病(自闭症、精神分裂症等)的风险位点和人类特异染色质开放区域进行了关联分析,发现人类精神疾病的风险位点除了在神经元中显著富集,也在人类神经前体细胞特异的染色质开放区域显著富集。该结果提示一些幼年或成年发病的人类精神疾病的致病机制可能要追溯到大脑神经发生阶段,也显示这些疾病具有人类特异的遗传基础,为未来疾病治疗提供了新思路。以上研究不仅揭示了人类大脑发育中的演化创新机制,而且为理解人类大脑的独特发育模式和精神疾病风险提供了新的视角。
近日,相关研究成果以Comparative single-cell multiome identifies evolutionary changes in neural progenitor cells during primate brain development为题在线发表于Developmental Cell。
该研究得到了国家自然科学基金委、中国科学院和云南省科技厅的资助。
文章链接:https://www.cell.com/developmental-cell/abstract/S1534-5807(24)00605-1
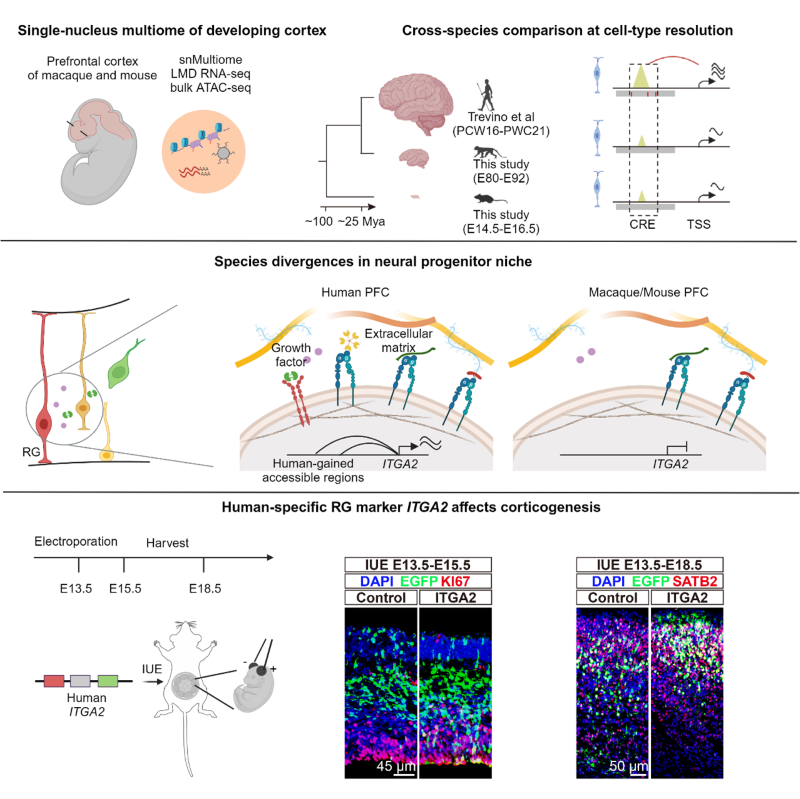
图.人类大脑发育演化创新的遗传机制解析
