昆明动物所合作发现灵长类大脑新细胞类型起源与特化的分子调控机制
前扣带回皮层(ACC)在灵长类大脑的功能网络中占据一个独特的位置,它通过远程神经投射将与“情感”相关的边缘系统和与“认知”相关的前额叶皮层相连接。ACC参与多种高级认知功能的调控,包括注意力分配、奖赏预期、决策和情绪调节等,并与多种人类精神疾病的发生相关。ACC虽然在哺乳动物大脑中是一个保守的皮层区域,但在细胞水平上,ACC在演化中发生了一个关键创新,即在体型较大的社会性哺乳动物中出现了大型投射神经元——纺锤形神经元(VEN)。VEN是一类特殊的双极神经元,以纺锤形胞体和粗大的顶树突和基底树突为特征。在灵长类中,VEN仅见于人类、猿类和旧大陆猴的大脑中,而在更原始的新大陆猴和原猴亚目的灵长类中不存在,表明其起源时间相对较近(约两千五百万年前)。在人类中,VEN较非人灵长类体积更大、数量更多。因此,神经生物学家猜测VEN可能参与调节ACC相关的高级认知功能。然而,目前我们对ACC中VEN的起源与人类特化的遗传机制了解很少,跨物种构建和解析ACC单细胞多组学图谱是了解在人类起源过程中人脑在细胞和分子水平演化创新的新视角。
中国科学院昆明动物研究所(以下简称“昆明动物所”)研究员宿兵团队与中国科学院数学院研究员张世华团队合作,对人类和猕猴的ACC进行了单细胞多组学的跨物种整合分析。研究发现,人与猕猴的兴奋性神经元亚型端脑外投射神经元(ET)显著高表达了超过一半的已知VEN标记基因,而其他神经元亚型则没有,这说明ET包含VEN细胞簇。通过与发表的小鼠数据比较,研究团队发现小鼠第V层锥体束神经元(L5-PT)与灵长类的ET神经元关系密切,并由此推测VEN可能起源于与L5-PT类似的神经元亚型。通过跨物种比较,研究团队筛选出16个人与猕猴共享的VEN标记基因和20个人类特异的VEN标记基因。这些基因在VEN中的特异高表达反映了这种新的细胞类型在灵长类大脑中起源和人类特化的分子特征。进一步,通过小鼠子宫电转实验,证实三个标记基因(PCSK6,ADAMTSL3,CDHR3)在小鼠胎脑前扣带回区的过表达导致第V层神经元的形态发生改变,产生了类似VEN形态的神经细胞类型,说明这些灵长类和人类特异的VEN标记基因在演化中的调控改变可能是导致VEN这种新细胞类型出现的分子机制。
除此之外,研究团队还解析了基因组中人类特异的序列改变对ACC中各种细胞类型基因表达调控的影响。通过整合人与猕猴差异的染色质开放位点(snATAC-seq)与基因表达数据(snRNA-seq),研究团队发现超过83%的物种间差异调控元件(cis-regulatory element,CRE)都存在人类特异的单点突变(SNC),且有671个人类加速进化区(HARs)落在了这些差异CRE位点上。由此,研究团队进一步分析了人类特异SNC对于转录因子结合的影响,构建了受到人类特异序列改变事件影响的基因调控网络,并发现其中的显著信号,包括ACC兴奋性神经元中HPCAL1和HAR1A基因的调控,小胶质细胞中SRGAP1和FOXP2基因的调控。同时,VEN中CDHR3基因上游也存在CRE元件受到人类特异SNC的影响。这些研究结果在一定程度上解释了基因组中人类特异序列改变对大脑ACC基因表达调控乃至人类高级认知功能产生的影响。
该研究首次构建了人类和猕猴大脑ACC这样一个重要脑区的基因表达和调控图谱,通过跨物种单细胞多组学比较分析揭示了灵长类大脑新细胞类型起源和人类特化的分子调控机制,助力我们进一步阐明人脑高级认知功能出现的遗传基础。
近日,相关研究成果以Single-nucleus multi-omics analyses reveal cellular and molecular innovations in the anterior cingulate cortex during primate evolution为题,在线发表于Cell Genomics。昆明动物所特别研究助理袁佳妙、数学院博士后董康宁(现为中国人民大学数学学院讲师)、昆明动物所博士研究生吴海旭、曾雪芮为文章的共同第一作者。宿兵和张世华为文章的共同通讯作者。
该研究得到了科技部重点研发计划、国家自然科学基金委、中国科学院和云南省科技厅的资助。
文章链接:https://www.cell.com/cell-genomics/fulltext/S2666-979X(24)00332-X
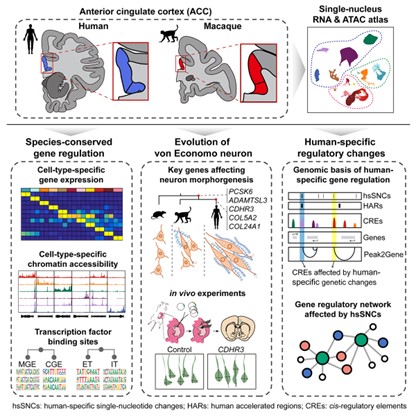
跨物种单细胞多组学解析灵长类大脑演化过程中的细胞和分子创新(示意图)
