昆明植物所在吲哚生物碱集群式全合成方面取得新进展
天然产物及其类似物是药物先导化合物发现与研究的重要资源。然而,如何高效制备结构多样性的天然产物及其类似物进行进一步的生物学研究仍然是一个重要的挑战。
近日,中国科学院昆明植物研究所(以下简称“昆明植物所”)赵勤实研究员团队基于高度统一的合成策略和新发展的铱/铒双金属接力催化脱氢螺环化反应高效地实现29个结构多样性吲哚生物碱的全合成(图1),该研究工作将铱催化脱氢偶联反应运用到吲哚生物碱全合成领域,也为高效制备类天然产物分子提供新的机会。相关研究成果以Unified Strategy Enables the Collective Syntheses of Structurally Diverse Indole Alkaloids为题发表于国际著名期刊《美国化学会志》(J. Am. Chem. Soc.)。
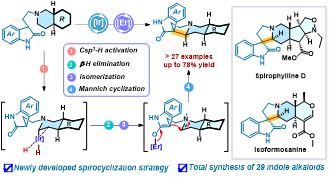
图1 文章TOC
螺环氧化吲哚生物碱是一类非常重要的生物碱,主要分布于钩藤属、帽蕊木属、马钱子属和萝芙木属植物中。在结构上,这类生物碱都具有螺[吡咯烷-3,3'-氧化吲哚]结构单元,并且具有广泛的生理活性,如抗阿尔茨海默病、抗帕金森病、抗抑郁、抗心率失常、抗高血压等。由于这类生物碱独特的化学结构和重要的生物活性引起了合成化学家和天然药物化学家的广泛兴趣。生源上,普遍认为螺环氧化吲哚生物碱是由相应柯南因和育亨宾生物碱通过氧化重排形成。迄今为止,螺环氧化吲哚生物碱的合成方法主要涉及仿生的氧化重排、分子内Mannich反应、[3 + 2]环加成反应和交叉脱氢偶联反应(图2b)。虽然前人已经做了很多漂亮的工作,但现有的方法只能完成单一或者少数几个目标分子的合成,无法实现该类生物碱的集群式合成,而且不对称合成的例子也非常有限。
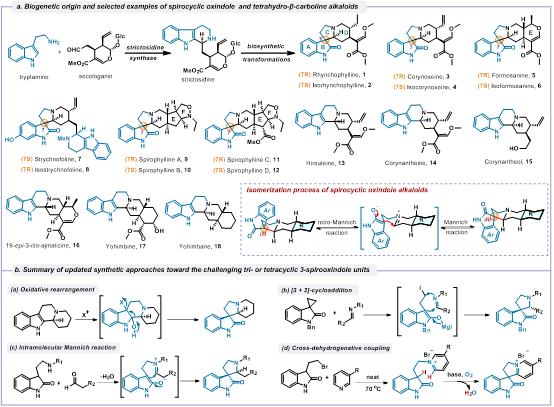
图2 螺环氧化吲哚和四氢- -咔波啉生物碱的生源及合成方法总结
赵勤实研究员团队通过生源启示发现螺环氧化吲哚、柯南因和育亨宾生物碱1-18(图2a)中均含有功能化哌啶子结构21-26(图3a),并且这些功能化哌啶结构可以由合成方法已知的手性哌啶19通过合理的化学转化获得。利用功能化哌啶21-26实现这些吲哚生物碱的全合成是极具潜力,但又富有挑战的设想,尤其是氧化吲哚底物29能否顺利发生脱氢螺环化反应直接得到螺环氧化吲哚生物碱存在很大的不确定性,因为三烷基胺的区位和立体选择性C-H活化一直是合成领域的难点。为此,该研究团队通过大量实验研究后,创造性地利用铱催化剂对底物29中的手性哌啶部分进行脱氢烯胺化(图3b),同时引入金属路易斯酸接力催化活化氧化吲哚的亲核位点,然后通过分子内Mannich反应一步合成螺环氧化吲哚生物碱,最后通过已知的逆生源重排反应将螺环骨架转化为四氢- -咔波啉骨架,进一步丰富全合成获得的骨架类型。在实际应用中,该研究团队基于高度统一的合成路线和新发展的脱氢螺环化策略,高效地完成了29个结构多样性吲哚生物碱的全合成。该研究工作将铱催化脱氢偶联反应的范围拓展到螺环氧化吲哚生物碱的全合成领域,也为其他复杂吲哚生物碱的合成提供新的灵感。

图3 螺环氧化吲哚和四氢- -咔波啉生物碱的合成设计及脱氢螺环化反应历程
昆明植物所博士后任健和科研助理丁仕华为论文共同第一作者,赵勤实研究员为本文通讯作者,研究工作得到国家自然科学基金重点项目(21837003)、青年基金项目(82104042)、中国博士后科学基金(2021M703286)等项目资助。
