姚永刚团队揭示HCV感染树鼩肝脏细胞免疫激活、代谢变化与炎症发生的动态应答特征
近期,姚永刚团队及合作者在国际知名期刊eBioMedicine发表题为“Single-cell atlas of hepatitis C virus inoculated tree shrew liver reveals immune activation,metabolic reprogramming,and persistent inflammation”的研究论文。该研究系统揭示了丙型肝炎病毒(hepatitis C virus,HCV)感染树鼩肝脏在单细胞层面的动态应答特征,为理解HCV感染初期的免疫与代谢调控提供了重要依据。
HCV感染是全球备受关注的公共健康问题之一。据世界卫生组织统计,截至2022年底,全球仍有约5000万慢性感染者,每年新增病例数约100万,导致约29万人死亡。以往基于单细胞转录组学对HCV感染者肝脏细胞的研究,多集中于慢性患者样本,揭示了肝脏细胞在病毒作用下复杂且动态的异质性图谱。然而,HCV感染在急性期往往缺乏典型症状,临床早期肝组织样本极难获取,导致研究人员对于HCV感染初期宿主,特别是其天然免疫系统如何被启动、如何与病毒博弈的认知仍然有限。这一知识缺口,短期内难以通过人体研究直接填补。
面对这一问题,HCV感染树鼩模型展现出了独特的研究价值。树鼩在进化上较啮齿类更接近灵长类,已被证实可被HCV感染并出现病毒血症及肝脏病理变化。树鼩HCV感染模型为我们提供了一个可控的、能够系统性捕获感染早期动态过程的实验窗口。通过该模型,我们可以在预设的时间点获取肝组织,从而直接研究病毒入侵宿主后的早期应答全景。
采用肝内注射HCV JFH1株基因组体外转录产物的方式接种树鼩,评估HCV体内动态的变化过程。同时,通过单细胞转录组(scRNA-seq)和单细胞核转录组(snRNA-seq)测序,结合靶向实验验证,系统分析了HCV接种急性期(1周)和长期(111周)树鼩肝脏的免疫反应及细胞间互作。通过分析157,298个树鼩肝脏细胞,鉴定到16种主要细胞类型。研究发现,急性HCV感染,可广泛诱导多数肝脏细胞类型中干扰素刺激基因的表达上调,其中以门静脉区域肝细胞的干扰素刺激基因高表达尤为显著。同时,肝细胞中糖异生、氨基酸代谢和尿素循环途径相关基因受到抑制,提示HCV感染早期即引发显著的代谢重编程。这一现象在HCV感染的树鼩肝细胞系ITH6中进一步得到验证,表明葡萄糖稳态破坏可能是驱动该过程的关键因素。此外,在急性感染期肝脏微环境中,观察到成红细胞亚群的积聚,且具有活跃的细胞间通讯特征,推测成红细胞可能在此过程中发挥了免疫抑制功能。他们还观察到接种HCV急性期及长期的树鼩肝脏,均呈现中性粒细胞显著富集现象,这种状态反映中性粒细胞向炎症部位的持续募集,以及中性粒细胞捕获网(NETs)的持续形成,表明尽管病毒已被清除,仍可能在肝脏中诱导长期存在的分子与细胞印记。该研究为理解HCV感染早期机制提供了宝贵的数据资源,也为进一步探索抗病毒策略与免疫干预途径奠定了重要基础。
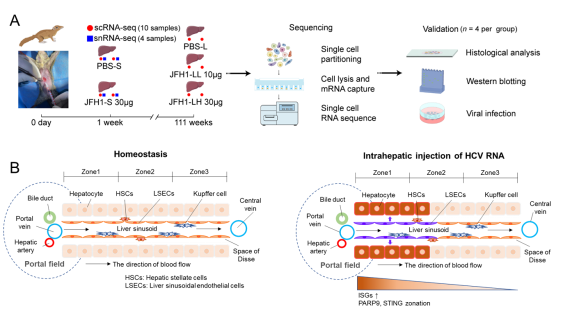
图1. HCV感染诱导树鼩肝脏广泛干扰素扰动与分区重构。A. 树鼩肝脏单细胞测序分析与实验验证流程图;B. 树鼩肝小叶分区模式图(左)与接种HCV RNA后树鼩肝脏免疫微环境动态变化图(右)。
该项论文研究的通讯作者为中国科学院昆明动物研究所姚永刚研究员和上海免疫与感染研究所/上海药物研究所钟劲研究员,第一作者为昆明动物研究所余丹丹副研究员和博士生康伟博。本项目的开展,得到了中山大学中山眼科中心刘胜教授和唐磊博士、中国科学院数学与系统科学研究院张世华研究员的大力支持与帮助。该研究获得国家自然科学基金委、云南省科技厅和中国科学院等项目资助。
文章链接:https://doi.org/10.1016/j.ebiom.2025.106080
作者:余丹丹
